Нобелевская премия по химии в этом году присуждена трем ученым, работающим в области дизайна белков и предсказания их структуры. Половина премии досталась Дэвид Буланже в Вашингтонском университете в Сиэтле, США, а другая половина была присуждена Демис Хассабис И Джон Джампероба из британской компании Google DeepMind.
Почему структура белка достойна Нобелевской премии?
Мы давно знаем, что белки — это химические инструменты жизни: существует множество типов белков, каждый из которых играет в нашем организме разную роль. Каждый белок состоит из цепочки аминокислот, которая складывается в определенную форму или трехмерную структуру, и функция каждого белка тесно связана с этой формой. Знание структуры белка помогает нам понять, как он работает, и на протяжении десятилетий ученые работали над способами понимания белковых структур, создавая на этом пути множество проблем.
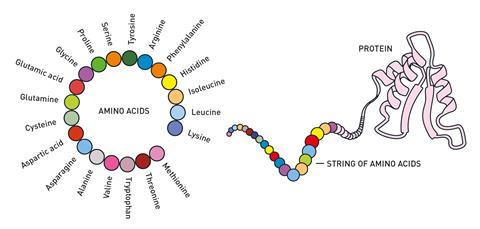
В 1950-х годах развитие рентгеновской кристаллографии позволило исследователям получить первые трехмерные структуры белков. За эту работу Джон Кендрю и Макс Перуц получили Нобелевскую премию по химии в 1962 году.. С тех пор в набор инструментов были добавлены другие экспериментальные методы, такие как ЯМР и криоЭМ, и исследователи теперь определили структуры около 200 000 белков.
В 1972 году Американский биохимик Кристиан Анфинсен получил Нобелевскую премию по химии за открытие того, что именно последовательность аминокислот определяет, как складывается полипептидная цепь, и что никакой дополнительной генетической информации не требуется. Это означает, что теоретически можно предсказать форму белка, просто зная его аминокислотную последовательность.
Это открытие привело к 50-летним поискам способа предсказать трехмерную структуру белка по его аминокислотной последовательности, но количество теоретически возможных конформаций белка, короче говоря, астрономическое.
Эта так называемая «проблема прогнозирования» стала серьёзным вызовом биохимии и привела к запуску в 1994 году проекта, ставшего конкурсом, под названием Критическая оценка предсказания структуры белка (CASP), целью которого было ускорить открытия в этой области. Однако потребовалось много лет, прежде чем был сделан значительный прорыв.
Премия этого года была отмечена двумя разными открытиями. Почему они делят цену?
Работы этих трёх учёных тесно связаны между собой. Хассабис и Джампер использовали искусственный интеллект (ИИ), чтобы предсказать трехмерную структуру белка только на основе его последовательности. Тем временем Бейкер разработал вычислительные методы, которые могли бы решить противоположную задачу: начать с белка с определенной структурой и определить, какую последовательность он будет иметь. Это позволило ему создать совершенно новые белки, которых раньше не существовало.
Вся эта работа основана на десятилетиях исследований и лауреатов Нобелевской премии по химии, направленных на понимание структуры белка.
Что на самом деле сделали победители?
В 1990-х годах Бейкер начал исследовать, как сворачиваются белки. Используя эти знания, он разработал Rosetta: компьютерное программное обеспечение для прогнозирования белковых структур.
Первоначально Rosetta использовалась для преобразования аминокислотных последовательностей в структуры, но после конкурса CASP 1998 года Бейкер и его команда решили использовать программу наоборот; метод, который в конечном итоге привел их к созданию совершенно новых белков, также известный как дизайн de novo.
Для этого они нарисовали белок с совершенно новой структурой и попросили Розетту определить, какую аминокислотную последовательность будет давать этот белок. Затем они ввели ген, кодирующий предложенную аминокислотную последовательность, в бактерии, которые произвели новый белок.Топ7. Используя рентгеновскую кристаллографию, они смогли определить, что созданный ими белок имеет структуру, очень похожую на ту, которую они изначально разработали.
Работа Бейкера и его коллег была опубликовано в 2003 г. а код Rosetta был обнародован мировому исследовательскому сообществу, что позволило продолжить разработку программного обеспечения и новых приложений.
В 2010 году Хассабис, британский исследователь информатики и искусственного интеллекта, основал DeepMind Technologies. Первоначально компания DeepMind разработала модели искусственного интеллекта для популярных настольных игр, а после ее приобретения Google в 2014 году она достигла важной вехи в машинном обучении, когда ее программа AlphaGo победила лучшего игрока в го в мире в 2016 году. Затем компания создала компьютерную программу на основе сверточная нейронная сеть под названием AlphaFold.
В 2018 году AlphaFold опередила остальную часть рынка на 13-м месте.й Конкурс CASP, достигший 60% точности предсказанных белковых структур. Но достижение более высокой точности поставило новую задачу.
Встречайте Джампера, исследователя с творческими идеями о том, как улучшить AlphaFold. Вместе Джампер и Хассабис совместно возглавили работу, которая привела к созданию AlphaFold2 в 2020 году, чему способствовали знания Джампера о белках и инновациях, лежащие в основе огромного прорыва в области искусственного интеллекта — нейронных сетей, называемых трансформерами, — которые могут находить закономерности в огромном объеме данных в более сложных условиях. гибкий способ, чем когда-либо прежде.
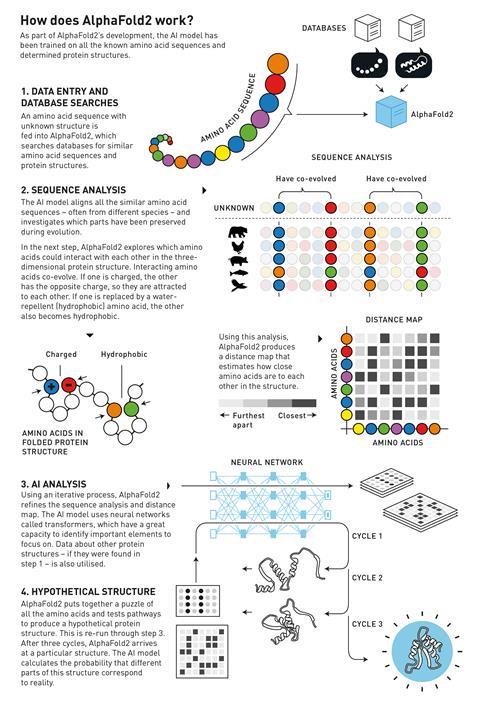
Когда в программу вводится аминокислотная последовательность с неизвестной структурой, она ищет в базе данных схожие аминокислотные последовательности и структуры белков. Затем сеть создает выравнивание похожих последовательностей, иногда принадлежащих разным видам, и ищет корреляции между ними, а также возможные взаимодействия между аминокислотами. На основе этой информации AlphaFold2 может затем итеративно уточнять карту расстояний, которая показывает, насколько близки две аминокислоты друг к другу в пространстве, и анализировать последовательность. Наконец, он преобразует всю эту информацию в трехмерную структуру.
Сегодня AlphaFold имеет более 2 миллионов пользователей и предсказал 200 миллионов белковых структур.
Каковы приложения этой работы?
Благодаря этим достижениям большинство мономерных белковых структур теперь можно предсказать с высокой точностью, что позволяет создавать большие базы данных, содержащие сотни миллионов структур. Белки являются настолько важной частью нашей биологии, что возможность их проектирования и прогнозирования их структуры открывает двери для потенциального применения в фармацевтике, наноматериалах, быстрой разработке вакцин и во многих других областях.
Означает ли это прекращение экспериментальных работ в этой области?
Нет сомнений в том, что разработка инструментов прогнозирования структуры белков искусственного интеллекта, таких как AlphaFold, представляет собой важный шаг в структурной биологии. но они не заменяют экспериментального определения структуры. Экспериментально определенные структуры всегда превосходят прогнозы, и они также понадобятся для создания наборов обучающих данных для следующих поколений инструментов ИИ, а также для оценки эффективности этих инструментов при прогнозировании структур.
Разработка лекарств является примером постоянной потребности в экспериментальных подходах. Хотя определение структуры белка может помочь сформулировать идеи о том, какие соединения создавать дальше, существует множество других факторов, касающихся биологической активности белков, которые следует учитывать, таких как фармакокинетика, метаболизм и токсикология, которые в настоящее время не могут быть решены с помощью ИИ.
Гораздо более вероятно, что будущее структурной биологии будет заключаться в интеграции высокопроизводительных экспериментальных исследований с ИИ, а не в его замене.



